透射电镜/扫描电镜(编号:1309)
一、服务介绍
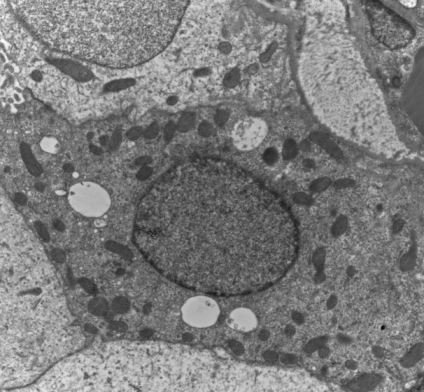
透射电镜,即透射电子显微镜(Transmission Electron Microscope,TEM),以电子束为光源,可以看到在光学显微镜下无法看清的小于0.2um的超微结构,放大倍数为几万到几十万倍。主要应用于物质内部的超微结构观察。
二、实验内容
1. 取材:组织块小于1立方毫米
2. 固定:2.5%戊二醛,磷酸缓冲液配制固定2小时或更长时间。用 0.1M 磷酸漂洗液漂洗15min,3次。1%锇酸固定液固定2-3h。用 0.1M 磷酸漂洗液漂洗15min,3次
3. 脱水:50%乙醇15-20min ,70%乙醇15-20min,90%乙醇15-20min;90%乙醇90%丙酮(1:1)15-20min, 90%丙酮15-20min(以上在4℃冰箱内进行)。100%丙酮,室温15-20min,3次
4. 包埋:纯丙酮+包埋液(2:1)室温3-4h;纯丙酮+包埋液(1:2),室温过夜;纯包埋液37℃ 2-3h
5. 固化:37℃烘箱内过夜,45℃烘箱内12h,60℃烘箱内48h
6. 超薄切片机切片70nm
7. 3%醋酸铀-枸橼酸铅双染色
8. 透射电镜观察,拍片
三、客户提供
1.组织样本:将组织切成 1 立方毫米左右小块(扫描电镜取材可稍大于该标准) 固定于 2.5%戊二醛固定液。
2.运输:4度冰袋运输
3、需要明确具体观察指标及要求,并提供相关结果示例图
提示:
a.取离心好的细胞团块时,如细胞分散,可在离心管中注入约 5ul 血清后再次离心,至 EP 管底部出现致密细胞团块,即送电镜室。
b.细胞大小不同,最佳离心富集速率和时间不同。提前检索文献,避免反复离心损伤细胞。
四、公司提供
1. 实验操作步骤、设备、试剂
2. 原始透射电镜图片,倍数依据实际情况选择合适放大倍数,5-8张
五、取材要求:
取材是电镜样品制备的第一步,也是十分重要的一步。其操作成功与否直接关系到整个实验的成败。 为了得到好的结果,请务必认真做好最关键的第一步取材。因取材不规范导致实验失败本公司概不负责!取材基本要点:快(1min)、冷(4 ℃)、小(1mm 3 )、净(无杂质)、准(部位准确)。
(1)细胞取材
1.确认细胞数量充足(150px 或 250px 皿长满),离心后在 ep 管中 绿豆大小;
2.新鲜配置的电镜专用 2.5%戊二醛固定液,PH值 7.3-7.4;
3.贴壁细胞用柔软细胞划子轻轻刮起成细胞悬液,尽量不要反复来回刮;
4.把细胞悬液置入洁净1.5ml尖头 PEP管;
5.选择合适的离心速度和时间离心,一般 1000rpm 至 3000rpm,5min 至 10min(转
速及洗的时间请根据具体情况具体分析,比较脆弱敏感的细胞,尽量低转速、短时间,
以细胞离心成团为准!S PBS洗的时间过长,容易造成自噬假阳性);
6.取细胞团块,如致密团结即弃上清,注入新鲜 2.5%戊二醛固定液,4℃保存;
(2)组织取材:
1.定位准确:解剖水平的准确定位误差应≤1mm。注意各组实验动物取材区位及方位的一致性和代表性。
2.操作迅速:组织离开活体后,以最快的速度浸入戊二醛固定液,0.5 min 或最多2 min。事先准备好 1.5ml尖头 PEP管里面盛满预冷的2.5%戊二醛固定液。
3.标本尺寸大小:组织块大小需要在 1mm 3 左右,样品太大会导致样品固定不充分。(提示:把较大标本块修整成符合要求的颗粒时,须事先准备一个蜡盘,滴入戊二醛固定液,把标本浸在液滴中修整,确认每个小标本颗粒都包含需要的结构内容,用牙签挑出 3~5 粒标本,放入1.5ml尖头PEP管。)
4.保持低温环境:为降低自溶酶活性,最好在 4℃低温条件下取材,容器和器械预冷;将修整好的标本块放入戊二醛固定液后,普通 4℃冰箱保存。