细胞生物学
| 1005 | |
| 发表时间:2017-08-25 阅读次数:388 | |
|
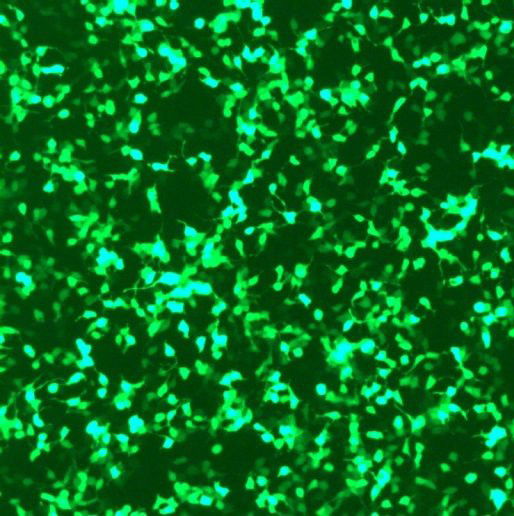
细胞转染(编号:1005) 一、实验介绍: 常规转染技术可分为两大类,一类是瞬时转染,一类是稳定转染(永久转染)。前者外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析。一般来说,超螺旋质粒DNA转染效率较高,在转染后24-72小时内(依赖于各种不同的构建)分析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来帮助检测。后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体(episome)存在。尽管线性DNA比超螺旋DNA转入量低但整合率高。外源DNA整合到染色体中概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶(APH;新霉素抗性基因),潮霉素B磷酸转移酶(HPH),胸苷激酶(TK)等反复筛选,得到稳定转染的同源细胞系。 转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA与转染试剂比例,细胞数量,培养及检测时间等。
二:实验流程: 1)转染试剂的准备 A.将400ul去核酸酶水加入管中,震荡10秒钟,溶解脂状物。 B.震荡后将试剂放在-20摄氏度保存,使用前还需震荡,。 2)选择合适的混合比例(1:1-1:2/脂质体体积:DNA质量)来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适质量的MyoD或者EGFP的DNA,震荡后在加入合适体积的转染试剂,再次震荡。 3)将混合液在室温放置10—15分钟。 4)吸去培养板中的培养基,用PBS或者无血清培养基清洗一次。 5)加入混合液,将细胞放回培养箱中培养一个小时。 6)到时后,根据细胞种类决定是否移除混合液,之后加入完全培养基继续培养24-48小时。 第二次细胞传代 1) 在转染后24小时,观察实验结果并记录绿色荧光蛋白表达情况。 2) 再次进行细胞传代,按照免疫染色合适的密度0.8X105个细胞/35mm培养皿将细胞重新粉入培养皿中。 3) 在正常条件下培养24小时后按照染色要求条件固定。 |
|